Criomicroscopía electrónica: la imagen perfecta
La criomicroscopía está revolucionando la biología estructural.
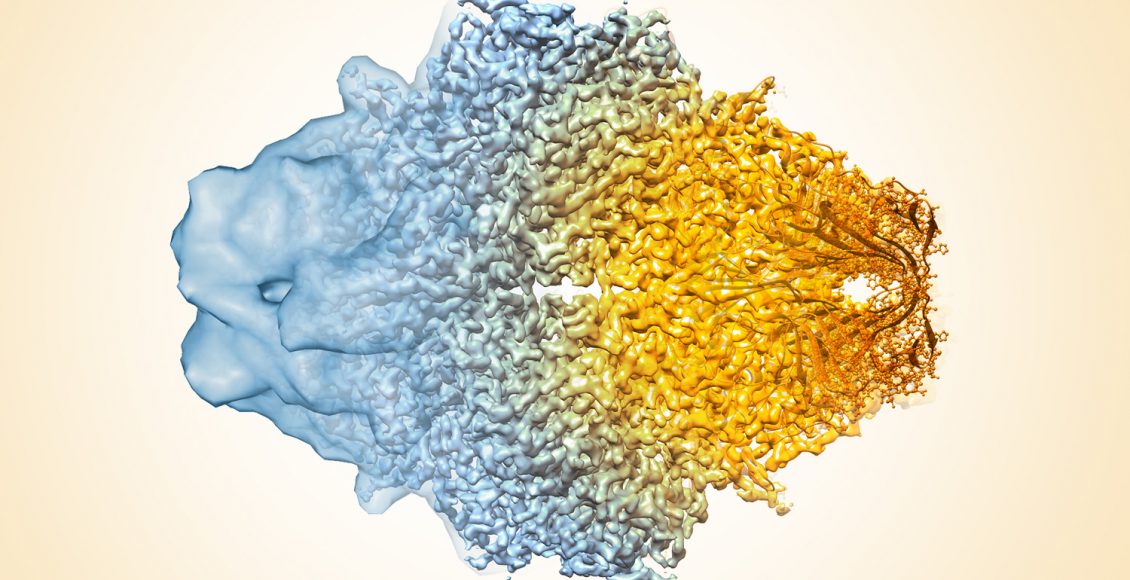 Imagen: Veronica Falconieri Sriram Subramaniam-National Cancer Institute National Institutes of Health
Imagen: Veronica Falconieri Sriram Subramaniam-National Cancer Institute National Institutes of Health
Las estructuras de proteínas resueltas mediante microscopía electrónica han aumentado exponencialmente debido al número de microscopios crioelectrónicos en los laboratorios de todo el mundo.
La técnica implica tomar proteínas que han sido bioquímicamente purificadas de las células y congelar instantáneamente la muestra en una grilla cryo-EM a -180 ºC. El objetivo de este proceso es atrapar muchas copias de una sola proteína o un complejo de proteínas en una capa delgada de hielo vitrificado. Este hielo es transparente al haz de electrones del microscopio y permite que las proteínas retengan su forma y organización natural.
Cada imagen contiene toda la información requerida para determinar la estructura tridimensional. Pero estas imágenes en bruto son difíciles de ver, por lo que se debe recolectar un gran número de imágenes para cada muestra usando el microscopio.
El análisis informático especializado combina cientos de miles de instantáneas 2D individuales desde diferentes ángulos en un compuesto que se puede ver en una estructura 3D de la molécula. Dichas estructuras son útiles para descubrir cómo funcionan las proteínas, cómo funcionan mal en las enfermedades y cómo atacarlas con medicamentos. Determinar cómo se mueve la máquina biológica de la célula en condiciones normales o alteradas como en las enfermedades como Parkinson o en infecciones como el HIV, permitirá avanzar en las terapias adecuadas.
El software también puede clasificar las proteínas que se encuentran en diferentes etapas de un proceso biológico, lo que ayuda a reconstruir cómo se mueve, cambia y funciona una máquina biológica.
Cryo-EM requiere grandes cantidades de potencia computacional y almacenamiento de datos. Una película cryo-EM de 30 a 60 cuadros requiere hasta 8 gigabytes de almacenamiento. Alrededor de mil de estas películas se recopilan en un día, lo que requiere entre uno y ocho terabytes de almacenamiento. Un conjunto de datos completo para una estructura tridimensional puede requerir 4.000 películas.
Los avances en hardware y software en 2012–13 produjeron microscopios electrónicos más sensibles y software sofisticado para transformar las imágenes que capturaron en estructuras moleculares más nítidas.
La capacidad de Cryo-EM para observar proteínas en un estado casi nativo está en marcado contraste con la cristalografía de rayos X, el estándar de oro de larga data para obtener imágenes biomoleculares de alta resolución.
Joachim Frank, Richard Henderson, y Jacques Dubochet, recibieron el Premio Nobel de Química 2017 por su trabajo en el desarrollo de la técnica.
Los costos de un Cryo-EM son aún muy elevados para la mayoría de las instituciones públicas y privadas. Los microscopios más potentes pueden superar los US 7 millones. También cuestan miles de dólares cada día y requieren laboratorios especializados que minimicen las vibraciones. Comprar solo el microscopio y la cámara especializada necesarios para recolectar estas imágenes cryo-EM cuesta mucho más de US 5 millones.
El desafío de la criomicroscopía electrónica es transformar estas herramientas en una técnica convencional para los científicos de todo el mundo.
