Se lanza un ensayo clínico de tres vacunas de mRNA contra el HIV
Se trata de uno de los primeros estudios de fase 1 que prueba la tecnología de mRNA para el HIV
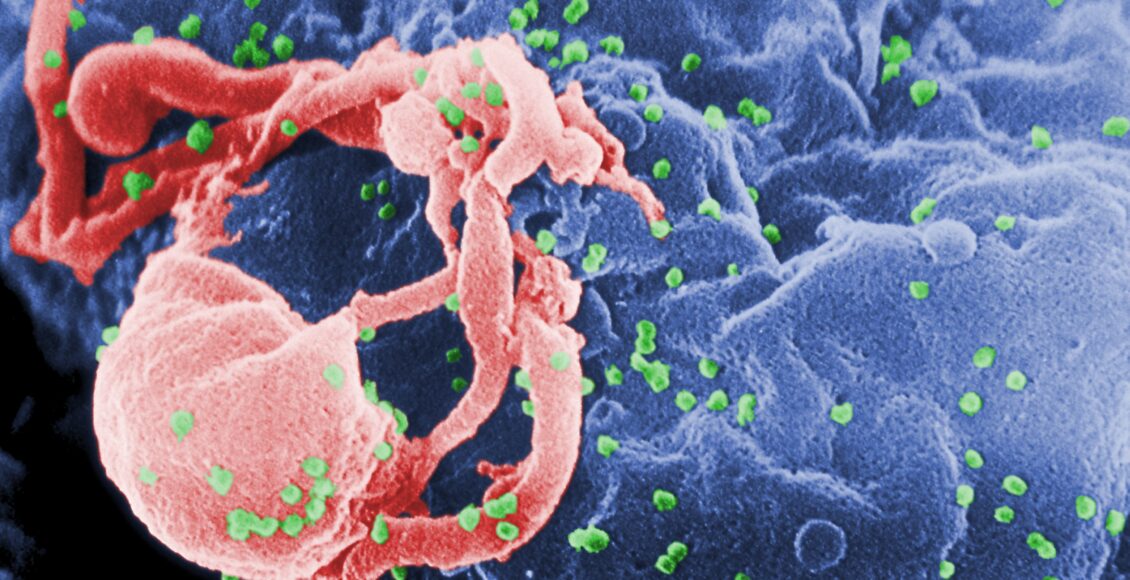 Imagen: Micrografía electrónica de barrido de HIV-1 (verde) liberándose de un cultivo de linfocito (azul). CDC-Wikipedia
Imagen: Micrografía electrónica de barrido de HIV-1 (verde) liberándose de un cultivo de linfocito (azul). CDC-Wikipedia
El National Institute of Allergy and Infectious Diseases (NIAID), parte de los National Institutes of Health (NIH), lanzó un ensayo clínico de Fase 1 que evalúa tres vacunas experimentales contra el HIV basadas en una plataforma de RNA mensajero (mRNA), una tecnología utilizada en varias vacunas ya aprobadas contra la COVID-19.
El estudio, llamado HVTN 302, es patrocinado por el NIAID, y la NIAID-funded HIV Vaccine Trials Network (HVTN), con sede en el Fred Hutchinson Cancer Research Center en Seattle, se encarga de la realización del ensayo.
Una vacuna de mRNA funciona mediante la entrega de una pieza de material genético (mRNA) que le indica al cuerpo que produzca un fragmento de proteína de un patógeno objetivo (como un virus), que el sistema inmunitario reconoce y recuerda, para que pueda generar una respuesta sustancial si luego se expone a ese patógeno.
El estudio HVTN 302 examinará la seguridad y respuesta inmunitaria de tres vacunas experimentales de mRNA contra el HIV: 1) mRNA de BG505 MD39.3, 2) mRNA de BG505 MD39.3 gp151 y 3) mRNA de BG505 MD39.3 gp151 CD4KO.
Cada candidata a vacuna en investigación está diseñada para presentar la proteína de punta que se encuentra en la superficie del HIV y que facilita la entrada en las células humanas. Cada una de las vacunas experimentales codifica proteínas estabilizadas diferentes pero muy relacionadas. Ninguno de los tres candidatos a vacunas puede causar infección por HIV.
Las secuencias de mRNA específicas contenidas en las vacunas fueron diseñadas y desarrolladas por investigadores del Scripps Consortium for HIV/AIDS Vaccine Development (CHAVD) financiado por el NIAID en el Scripps Research Institute y el IAVI Neutralizing Antibody Center at Scripps financiado por la Fundación Bill y Melinda Gates, en colaboración con científicos de Moderna, Inc., con sede en Cambridge, Massachusetts. Moderna fabricó las vacunas en investigación a través de un contrato respaldado por el NIAID.
Dirigido por los investigadores principales Jesse Clark, MD, de la University of California Los Angeles, y Sharon Riddler, MD, de la University of Pittsburgh, el estudio HVTN 302 inscribirá hasta 108 adultos de 18 a 55 años en 11 sitios en: Birmingham, Alabama; Boston; Los Angeles; Nueva York; Filadelfia; Pittsburgh; Rochester, Nueva York y Seattle.
Cada participante será asignado al azar a uno de los seis grupos, cada uno de los cuales recibirá tres dosis de una de las vacunas experimentales. Los primeros tres grupos (18 participantes cada uno), llamados Grupo A, recibirán inyecciones intramusculares de 100 microgramos (mcg) de su vacuna candidata asignada en la visita inicial, en el mes dos y nuevamente en el mes seis.
Los participantes del Grupo A serán evaluados dos semanas después de la vacunación inicial para garantizar que se hayan cumplido los criterios de seguridad. De ser así, los tres grupos restantes de 18 participantes cada uno (Grupo B) serán vacunados con 250 mcg de la vacuna en investigación asignada, seguido de inyecciones dos y seis meses después de la vacunación inicial.
La seguridad y las respuestas inmunitarias se examinarán a través de muestras de sangre y ganglios linfáticos tomadas en momentos específicos durante todo el ensayo. El personal clínico supervisará de cerca la seguridad de los participantes durante todo el estudio. Se espera que el ensayo clínico se complete en julio de 2023.
NIH es la agencia de investigación médica de los Estados Unidos, incluye 27 Institutos y Centros y es un componente del U.S. Department of Health and Human Services. NIH realiza y apoya la investigación médica básica, clínica y traslacional, y está investigando las causas, los tratamientos y las curas para enfermedades comunes y raras. Más información sobre el estudio HVTN 302 está disponible en ClinicalTrials.gov usando el identificador NCT05217641.
